

走进南宫28
NEWS南宫28解码蛋白结构,助力病毒疫苗研发
来源:裘茗哲 日期:2025-02-10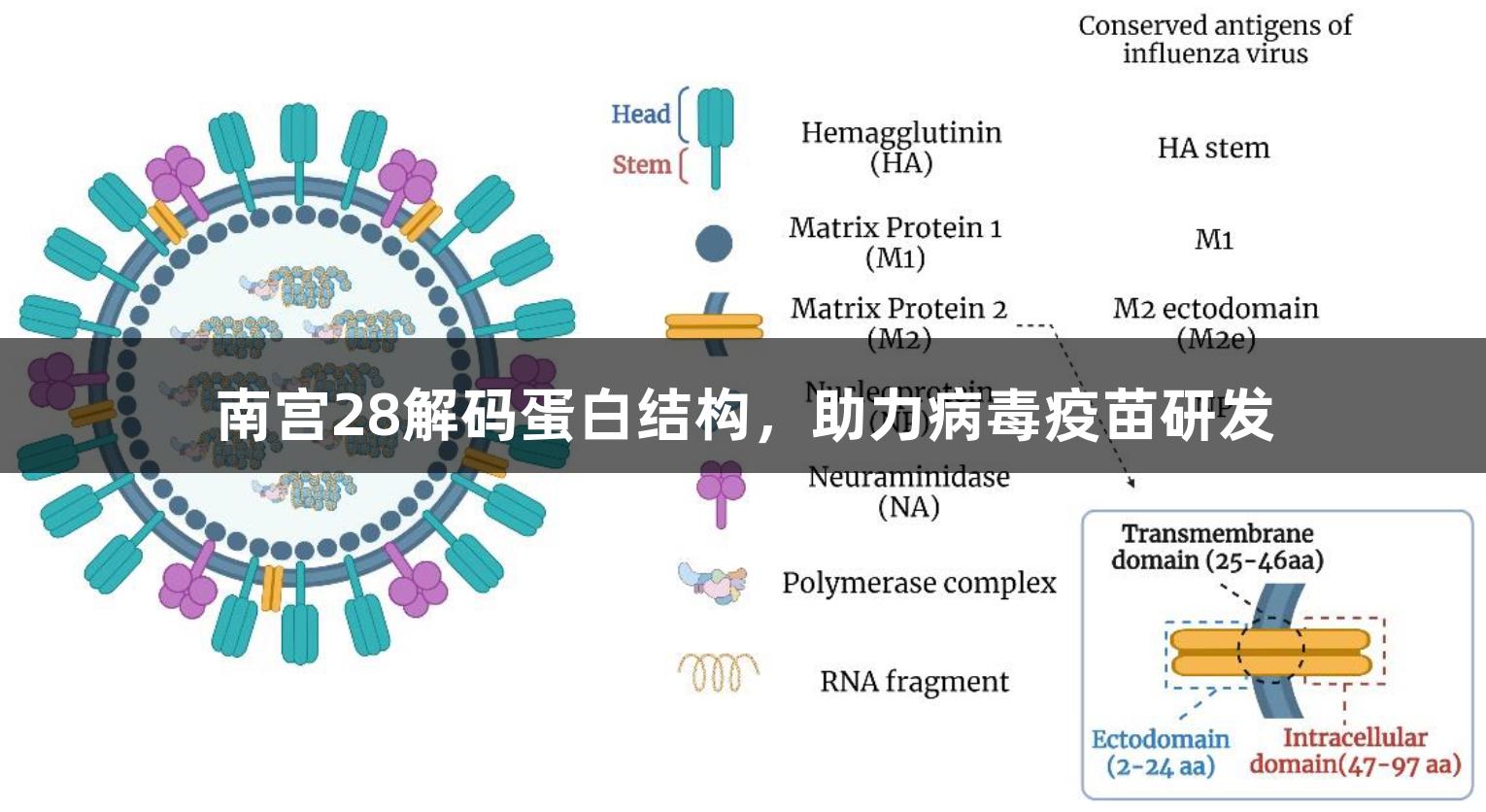
传统的疫苗设计往往依赖经验,但随着结构生物学和免疫学的发展,基于蛋白质抗原结构的疫苗设计理念逐渐兴起。新方法为病毒表面蛋白提供了原子级别的结构信息,使得单克隆抗体的快速鉴定和筛选成为可能,从而设计出更有效、稳定且具有针对性的疫苗。高分辨率结构的解析能揭示中和抗体识别的静电特征及相关结合位点。通过分析病毒蛋白结构,科研人员能够确定哪些亚结构需要保持完整,哪些可进行优化改造。例如,在流感疫苗的设计中,主要针对病毒表面三种蛋白质:血凝素(HA)、神经氨酸酶(NA)和基质蛋白2(M2),利用结构疫苗学进行抗原设计,以获得稳定高效、具有跨亚型保护作用的重组抗原。
呼吸道合胞病毒(RSV)疫苗的成功证明了结构学设计理念的有效性。目前,获批的RSV疫苗中,免疫原为F蛋白。尽管早在20世纪60年代,科研人员便开始RSV疫苗的研发,但由于ERD影响,该进程一直停滞。随后,结构性或构象疫苗的提出以及RSV F蛋白的稳定结构成功推动了近十年来RSV疫苗的突破性进展。F蛋白存在融合前构象(pre-F)和融合后构象(post-F)两种主要形态。2013年,McLellan通过X射线晶体学确定了F蛋白的精确结构,发现RSV在进入细胞前F蛋白呈现为“棒棒糖”形态,进入细胞后则类似“高尔夫球台”。研究表明,结构稳定的pre-F是产生有效免疫反应的关键。Crank等人于2019年在《Science》发表的文章中,通过引入S155C和S290C两个点突变,形成二硫键并填充F蛋白构象上的空腔,提升了蛋白的稳定性。这一基于改造的F蛋白通过CHO细胞表达稳固的融合前F蛋白三聚体亚单位疫苗DS-Cav1。
通用流感疫苗的研究正处于有利时机。针对HA、NA和基质蛋白M2胞外区等靶点的研究显示,血凝素蛋白(HA)是一种关键的糖蛋白,它通过与宿主细胞膜上的唾液酸受体结合,促进病毒与宿主细胞膜的融合。由于HA的顶部区域易发生抗原漂移,而不同亚型的HA茎部则高度保守,因此,去除HA顶部区域的设计理念能够产生广泛的免疫反应,是通用流感疫苗开发中的重要策略。神经氨酸酶(NA)作为流感病毒另一种关键表面糖蛋白,在病毒释放中也扮演着重要角色,其相对保守性使它成为抗病毒药物及通用流感疫苗开发的潜在靶点。基质蛋白M2则作为膜蛋白,参与维持病毒侵入细胞时的酸性环境,其胞外区(M2e)被广泛认为是开发通用流感疫苗的热议靶点。
根据明尼苏达大学传染病研究与政策中心CIDRAP的统计,截至2025年1月7日,全球已有165款通用流感疫苗处于临床前研究阶段,42款疫苗进入临床研究阶段,其中16款、18款和8款疫苗分别进入Ⅰ期、Ⅱ期和Ⅲ期临床试验。尽管目前尚无通用流感疫苗产品上市,但随着技术的日益成熟,以及科研人员对疫苗研发的持续投入,我们有理由相信,未来有望开发出通用流感疫苗,增强流感预防和应对潜在流感大流行的能力。
南宫28拥有先进的技术平台和丰富的生产经验,能够为灭活疫苗、重组蛋白疫苗、DNA疫苗、mRNA疫苗和病毒载体疫苗等多个类型的疫苗研发提供解决方案。我们的产品和服务涵盖从早期开发、临床前研究、临床试验到生产和质量控制的全流程,旨在高效推进客户的研发项目。同时,南宫28持续关注行业动态,不断创新和丰富自身的产品线,以更好地服务客户,推动疫苗研发的进展。
全国客户服务热线
13796697644
总部地址:石家庄高坪区宗街道75号